2016年美国6岁小女孩 Eliza O‘Neill 开展了一项“神奇”的基因治疗。她患有一种叫做沙费利波综合征IIIA型(Sanfilippo syndrome III A)的罕见遗传病,引发体内寡聚糖的过度累积,逐步对机体造成损伤,阻碍智力发育,通常情况下,成年前会引起死亡。
为了争取一线生机2016年5月10日,俄亥俄州哥伦布全国儿童医院的医生团队将一种称为AAV的无害病毒注入Eliza血液中。目前为止,Eliza一直反应良好。妈妈Cara表示:“现在,她会用眼神跟我们交流,并试图开口说话。我们在她的眼睛里重新看到了光彩。
”基因治疗真的那么“神奇”吗?它是如何发展的,未来又将走向何方?
1 基因治疗:半个世纪的浮沉
1953年Watson和Crick提出了DNA双螺旋的结构模型,是分子生物学划时代意义的伟大事件,从此生命科学的研究进入到了分子水平。半个世纪以来,分子生物以空前的速度迅猛发展,极大的推动了基因工程技术和基因治疗的发展。不久之后,Nirenberg和Khoran等人相继破解了遗传密码,揭示了从DNA到蛋白质的阅读方式为三个碱基组成的三联体对应一种氨基酸,为我们打开了解人类基因奥秘的大门。
1957年Crick提出了遗传信息传递的中心法则:DNA→RNA→蛋白质。1970年巴尔的摩(Baltimore)提出了RNA病毒在宿主细胞中的复制过程是先以病毒的RNA分子为模板合成一个DNA分子,再以DNA分子为模板合成新的病毒RNA,被称为逆转录,是中心法则的重要补充,为如何实现高效表达外源基因提供了理论支撑,从此基因治疗逐渐步入人们的视野。
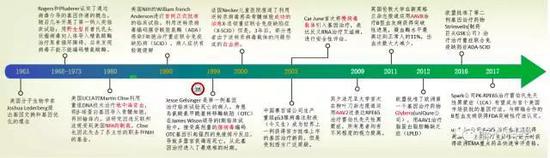
图1 基因治疗的发展历史
黑暗中的探索(1960s-1980s)
1963年美国分子生物学家、诺贝尔生理学或医学奖获得者乔舒亚·莱德伯格(Joshua Lederberg)提出了基因交换和基因优化的理念。随着分子生物学技术的进一步发展,同源重组技术为代表的基因工程技术蓬勃发展,基因治疗具备了最基本的条件。
在黑暗中摸索的人们开始了大胆的尝试:经过多年的研究,1968年Rogers和Pfuderer第一次在烟草花叶病毒中实验证实了病毒可以作为一种载体实现基因传递的作用。随后,他们在人体上第一次开展了基因治疗的尝试,运用野生型的肖普氏乳头状瘤病毒过表达精氨酸酶来治疗患精氨酸血症的一对姐妹。可惜的是,这次试验失败了,没有检测到精氨酸酶水平的升高,后来证实这种病毒体系无法表达精氨酸酶[1],幸运的这次试验没有对患者造成伤害,但是在那个无论对疾病还是基因递送和表达体系都不清楚的年代,这项试验显然是非常大胆的。
1980年前后,美国加州大学洛杉矶分校(UCLA)的马丁·克莱因(Martin Cline)在再一次对基因治疗发起了挑战,这次他们选择的是地中海贫血症。他们利用DNA重组技术将β-球蛋白导入患者的骨髓细胞中,然后回输到体内。本次尝试因为效率非常低下而再次失败了,同时本次实验也受到了更广泛的质疑。调查发现克莱因并没有获得UCLA伦理委员会的批准,而且前期的动物实验并没有效果就直接应用到人体中[2]。克莱因本人也因为违反美国联邦法规而受到了严厉的制裁,同时被剥夺了系主任的职务。
这两起基因治疗的尝试,让人们意识到基因治疗不仅门槛很高而且面临着更为复杂的伦理问题,这样没有监管的盲目尝试是极其危险的。不久美国NIH DNA 重组委员会组建了基因治疗分委员会,经过讨论人们逐渐意识到摆在面前的几个障碍:首先是如何实现高效的DNA整合,如何准确的获得特定的功能基因;其次如何在靶细胞中高效的传递目的基因。在这些困难没有解决之前,基因治疗不可能成功。这标志着基因治疗已经开始逐渐走向正轨,逐渐开始规范化和系统化。
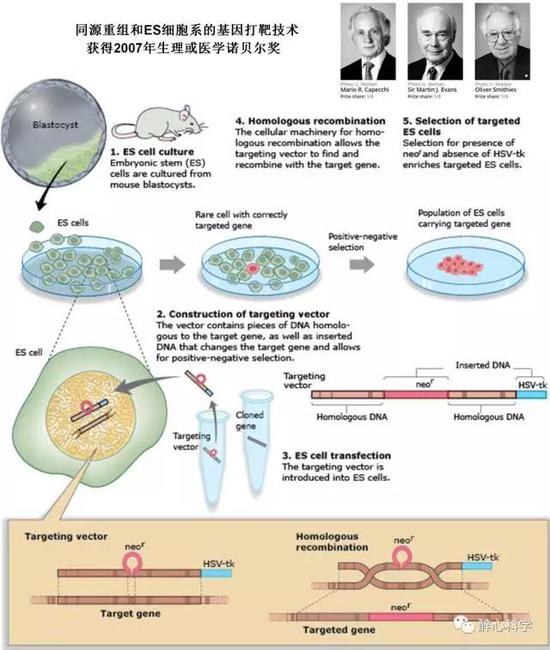
图2 基于同源重组和ES细胞系的基因打靶技术 (来自 https://www.nobelprize.org/nobel_prizes/medicine/laureates/2007/illpres/page_three.html)
冒进式的快速发展(1990-2003)
1984年西斯特公司的穆利斯(K.B.Mullis)开发的聚合酶链式反应(PCR)技术首次获得成功,他也因此获得了1993年的诺贝尔化学奖。PCR技术的完善和基因克隆技术的逐渐成熟,使人们能够准确的获取目的基因。1970年巴尔的摩(Baltimore)发现的逆转录病毒,不仅完善了中心法则,更是为基因治疗提供了高效的导入方法。此外,腺病毒、腺相关病毒(AAV)和慢病毒等病毒系统也逐渐被开发利用[3]。
至此,基因治疗的主要障碍逐渐被攻克,多个研究组的体内外动物实验也验证了病毒介导的基因纠正和替代的可行性和有效性。人们再一次相信基因治疗近在咫尺了,众多的临床试验如雨后春笋般一个个开展起来。
图3 基因表达和传递的载体系统 [3]
1990年美国NIH的威廉·弗伦奇·安德森(William French Anderson)开展了世界上首例正式批准的人体临床试验[4],利用逆转录病毒编码腺苷酸脱氨酶(ADA)来治疗重症联合免疫缺陷病(SCID)。
首先从四岁女孩阿莎提·德席尔瓦(Ashanti DeSilva)提取白细胞,然后将编码正确ADA基因的逆转录病毒插入到白细胞基因组中,然后将细胞回输到体内。后续检测发现,女孩体内能正确合成腺苷酸脱氨酶,但是由于白细胞存活时间短,需要经常接受类似的治疗。尽管该疗法是否真正意义上获得成功还有争议,但是该临床试验都是基因治疗历史上重要的里程碑。
(图片来自http://www.healthandfitnesstalk.com/sudden-combined-immunodeficiency-disorder-scid/)
随着这次基因治疗的成功,大量的公司和研究机构纷纷涌入基因治疗领域,其中绝大部分是肿瘤的基因治疗。然而就在基因治疗蓬勃发展的过程中意外出现了,1999年9月13日,杰西·格尔辛格(Jesse Gelsinger)成为了第一例因基因治疗死亡的病例[5]。杰西身患鸟氨酸氨甲酰基转移酶缺陷(OTC),在由宾夕法尼亚大学的詹姆士·威尔森(James Wilson)领导的I期临床试验中,注射高剂量的编码OTC基因的腺病毒后引起强烈的免疫排斥反应,导致多器官衰竭而死亡。
据FDA调查,此次恶性时间的发生与宾夕法尼亚大学的违规操作不无关系,临床前的猴子试验中有两只死亡,没有引起实验人员的足够重视,也没有及时通知FDA,更没有告知病人及家属此项临床试验的风险性。因为这次事件,基因治疗进入了最黑暗的一段时间,造成了人们对基因治疗的恐惧和排斥。有些科学家也对基因治疗开展的过快表示担忧,并呼吁基因治疗需要“重回实验室”。
图5 美国男孩杰西·格尔辛格(Jesse Gelsinger)
(图片来源http://www.jesse-gelsinger.com/jesses-intent2.html)
2000年,法国内克尔医院研究组报道了利用逆转录病毒感染骨髓细胞成功治愈X-连锁重症联合免疫缺陷症(X-SCID)[6]。但是3年后,在20个接受治疗的患者中,有5位发展成白血病,其中1位死亡,后来发现诱发白血病是因为逆转录病毒在基因组中的随机插入激活了癌基因的表达所致。
这两起病人恶性事件极大的打击了基因治疗的发展,造成了基因治疗最为黑暗的10年。但同时也使人们慢慢从巨大的商业利益中清醒,重回理性:更深入的了解疾病的机理,寻找更为高效的基因递送系统,针对性的设计基因治疗策略,更加重视安全性的评估。
国内相关领域开展的较晚,不过2003年中国深圳的宜家公司——赛百诺异军突起。公司开发的抗肿瘤基因药物(今又生)由国家食品药品监督管理局批准生产,该注射液由通过修饰的腺病毒载体编码p53基因(抑癌基因)组成。“今又生”的获批批准,成为世界上第一个获准上市的基因治疗药,但是该项目的获批引起国内外的广泛争议。
回归理性(2009-至今)
经理了黑暗的十年之后,基因治疗缓慢的走出困境,以更加成熟的姿态重回大众的视野。经历过以前惨痛教训之后,人们开发出更安全有效的病毒载体,比如2002年Jamse Wilson开发了重组AAV2/8 系统能高效靶向肝脏细胞[7],第二代和第三代慢病毒包装体系以及自身失活型(SIN)的慢病毒骨架进一步提高的安全性。
2003年人类基因组测序完成以来,测序技术飞速发展,不仅使我们更加深刻的理解生命,也为更合理的设计基因治疗策略,更方便的进行安全性和有效性评估提供了良好的平台。基因编辑技术的发展,尤其是2013年以来CRISPR-Cas9技术的发展,为我们高效的进行基因操作提供了强大的工具。
2009年宾夕法尼亚大学在柳叶刀杂志[8]报道通过AAV2过表达RPE65成功治疗雷伯氏先天性黑蒙症(LCA)。2011年,英国伦敦大学在新英格兰[9, 10]报道通过AAV8过表达凝血因子IX,体内凝血酶表达水平2%-11%之间,出血次数大大减少,除了谷丙转氨酶略微升高没有其他不良反应。
2012年第一例基因治疗药物Glybera(来自uniQure公司)在欧盟获批上市,开始的基因治疗的新时代。该产品采用AAV1过表达的方法治疗脂蛋白脂肪酶缺陷(LPLD),不过该药物售价100万美元,四年来只用了一次。 2016年欧盟第二例批准的基因治疗药物来自制药巨头葛兰素史克(GSK)的Strimvelis,用于治疗重症联合免疫缺陷病(ADA-SCID),这是基因治疗走向临床的有一个里程碑。
除此之外,自2014年以来,Spark公司的的SPK-RPE65治疗雷伯氏先天性黑蒙症(LCA),与辉瑞公司合作的SPK-9001治疗B型血友病; BluebirdBio公司的LentiGlobin治疗地中海贫血; uniQure的AMT-060治疗B型血友病以及 AVeXis公司的FDAAVXS-101等先后获得美国FDA授予的“突破性疗法”资格。“突破性疗法”旨在加速开发及审查治疗严重的或威胁生命的疾病的新药。
同时uniQure的AMT-060治疗B型血友病也获得的欧洲药品管理局(EMA)授予了重点药品快速审评(PRIME)资格,PRIME(Priority Medicines)是EMA在2016年3月推出的一个快速审评项目,旨在加速医药短缺领域重点药品的审评进程。入围PRIME的实验性药物,将在临床试验及药品开发方面获得EMA的大力支持,以加速真正创新药物的开发及审批,来满足对有前景新药的医疗需求。
21世纪以来以核酸酶为代表的基因编辑技术蓬勃发展[11],比起传统的同源重组技术,不仅更加高效而且操作更加灵活;跟现在常用的利用过表达基因来实现基因治疗相比,利用基因编辑技术的基因治疗能实现永久的治愈,但同样也面临更大的挑战。而且,大范围核酸酶,锌指核酸酶,TALE核酸酶以及近几年火热的CRISPR-Cas9技术的应用,极大地拓展了基因治疗的策略和手段,比如我们既可以对突变基因进行原位的修复,也可以在安全位点(例如AAVS1位点)定点整合,不仅可以实现永久的基因治疗,而且更加安全有效。但是目前大多试验停留在动物水平上,张峰的Editas公司宣称要在2017年开展基因编辑技术进行基因治疗的临床试验。
图六 基因编辑技术的发展 [11]
2 基因编辑和基因治疗的伦理争端
因治疗技术分为体细胞的治疗和生殖细胞的治疗。体细胞治疗主要指利用基因工程技术在病人细胞内校正给病人的遗传缺陷,而生殖细胞治疗是指对人体的精子、卵子或者受精卵进行基因修饰从而达到治疗遗传病的目的。理论上生殖细胞治疗能够彻底根治遗传病,但是由于目前技术不成熟,一旦技术上发生问题很难纠正,可能传给后代从而扩散到人群中,更重要的是对生殖细胞的基因修饰有可能定点改变人的正常特性,比如可能让人更聪明,或者体格更健壮等,有可能带来严重的伦理争端。所以为了避免未知的风险,目前绝大多数人认为基因治疗主要限定在体细胞治疗,不能在生殖细胞中开展。
体细胞基因治疗的伦理问题
体细胞的基因治疗并非没有伦理争端,早期的基因治疗失败的教训很大程度上就是因为没有处理好相关的伦理问题引起的,主要包括受试者的知情同意问题,研究者和受试者之间的利益冲突以及科学家的科研责任和社会责任等。以著名的1999年杰西。 格辛戈死亡事件为例,本次临床试验严重违背伦理审查,首先研究团队对招募患者存在误导和欺骗,网站没有公布猴子试验的免疫排斥和死亡的实验结果,而且最后签署的知情同意书也没有提及。
其次,威尔森实验室有意向NIH的重组DNA委员会隐瞒了向受试者肝内注射病毒载体这一事实。而且为保护患者利益,应避免研究人员和受试者直接接触,特别是当时威尔森还拥有公司并对基因治疗相关技术拥有专利权,更应该避免研究人员和受试者的接触,因为受到经济利益的影响,更容易让研究人员出现夸大研究效果,隐瞒潜在的风险等问题。
生殖细胞基因治疗的伦理问题
生殖细胞的基因治疗的争议一直以来争议不断,早期的研究由于技术条件比较落后,所以大部分还是坚决反对针对生殖细胞的基因治疗。争论的焦点在于当技术发展到什么程度可以放开对生殖细胞的治疗,治疗应该限定什么样的条件。
随着基因编辑技术的发展,特别是2013以来年CRISPR-Cas9技术的飞速发展,有些人认为现在对生殖细胞编辑的时代是否来临?各种讨论和争议接踵而来,2015年3月《麻省理工科技评论》杂志上发表了一篇名为“定制完美婴儿”的文章[12]中,作者表达了对于CRISPR技术应用于人类胚胎的担忧:一方面由于CRISPR系统存在的脱靶效应,可能会在非靶位点的位置产生切割效应;另一方面,CRISPR/Cas9并不能在胚胎中造成100%的切割,而且不同细胞产生不同的切割效应,很难保证在所有细胞中都得到相同的精确修饰。
随后2015年4月18日,中山大学黄军就等[13]在《蛋白质与细胞》杂志上发表文章,利用CRISPR/Cas9技术对人类胚胎中导致β型地中海贫血症的致病基因进行了修饰,这是首次对人类自身胚胎进行的突破性基因编辑尝试。尽管该研究所使用的是医院人工授精过程中废弃的不能正常发育的人类胚胎,并于实验48小时后终止实验,而且获得了中山大学附属第一医院伦理委员会的批准并符合相关法律,但是该论文一经发表,立刻引起了生命科学界的激烈讨论和国内外媒体的广泛关注,英国生物学家爱德华·兰菲尔在《自然》杂志上对这一研究进行批评,认为应该暂停此类研究,并表示需要广泛讨论后才能进行下一步研究。
哈佛大学医学院干细胞学家乔治·戴利认为,这是国际上首次报道成功使用CRISPR/Cas9技术对人类胚胎细胞进行的基因编辑,这一研究无疑具有里程碑意义,但是绝对不要误以为已经可以将这项技术应用于人类疾病治疗。伦理学家担心如果该技术一旦应用到生殖细胞中,是否能会造成人工设计婴儿,从而改变人的身高、智力甚至容貌,给人们带来未知的恐慌,加剧社会矛盾。
这一事件引起的全世界范围的广泛争论,2015年5月Nature Biotechnology [14]邀请基因编辑领域的大牛Jennifer doudna, Emmanuelle Charpentier, Feng Zhang,Qi Zhou,J Craig Venter以及社会各界人士针对CRISPR-Cas9 技术编辑人类生殖细胞的伦理问题进行的深入的讨论,从科学上、社会上等各个方面发表的不同的看法。这些激烈的争论也间接的促成了2015年12月为期三天的人类基因编辑国际峰会的召开,来自世界各地基因编辑领域的顶尖学者共同探讨飞速发展的基因编辑技术的基础研究变革、潜在应用,以及这项革命性技术带来的科学、伦理和监管问题。
在华盛顿会议结束后发表的声明中明确表示,因为生殖细胞的临床应用将会作用在被编辑后代的所有细胞上, 该编辑基因会传至其后代并成为人类基因库中的一员。生殖细胞的基因编辑还存在各种技术层面、社会层面以及伦理道德层面的问题, 其安全性目前还无法估计, 且一旦被编辑的基因进入人类基因库, 该影响不可逆, 不受地域限制。在目前状况下禁止用于人类生殖的相关细胞系(包括精子、卵和早期胚胎)的基因修饰和编辑,这也是第一次在这样的国际会议上达成的共识。但是,大会鼓励基因编辑技术的基础研究以及在体细胞层面上的临床应用。
然而仅仅过去了三个月,2016年2月1日英国人类受精与胚胎管理学管理局(HFEA)宣布,弗朗西斯克里克研究所发育生物学家凯西?尼娅坎和她的团队获得一项“包括对人类胚胎进行基因改造”的新实验室研究许可证。管理局允许尼娅坎对人类胚胎进行为期14天的实验,且该实验只能以研究为目的,研究人员不能将胚胎编辑用于临床,也不能将编辑后的人类胚胎植入女性体内。
2016年4月22日,日本生命伦理专门调查委员会宣布,允许日本相关机构在基础研究中“编辑”人类受精卵的基因,但出于安全和伦理方面的考虑,不允许将该技术应用到临床和辅助生殖中。该委员会指出,涉及受精卵基因编辑的基础研究和临床研究的分界线,在于是否将经过基因编辑的受精卵放入子宫。此外,有关“设计”特定容貌和能力的基础研究也不会被允许。受精卵基因编辑的基础研究还必须公布实施情况,保持透明度。
然而时隔一年不到,2017年2月14日美国在设置了诸多前提的情况下,对基因编辑是否可以用于人类生殖细胞谨慎放开。美国国家科学院与美国国家医学院下属的人类基因编辑委员会发布了一份长达261页报告[15],表示在严格的监管和风险评估下,基因编辑技术可用于对人类卵子、精子或胚胎的编辑,但仅限于父母双方均患有严重遗传疾病、想要健康的孩子却别无选择时。报告还提出了必须满足一下10条规范标准,生殖细胞的基因编辑才被允许:
(1)仅当不存在其他的“合理的替代选择”时,才使用基因组编辑;
(2)它仅用于阻止一种“严重的疾病或症状”;
(3)这种使用仅限于修饰“有力地证实导致或者非常倾向于患上这种疾病或症状”的基因;
(4)这种使用仅限于将基因转化为“在人群中普遍存在的、已知与正常的健康相关联的版本,而且没有或者很少有证据证实副作用的存在”;
(5)针对使用这些技术的潜在风险和潜在健康益处,存在可靠的临床前和/或临床数据;
(6)在临床试验期间,针对这些技术对研究参与者的健康和安全性的影响,进行持续的和严肃的监管;
(7)存在一种尊重个人自主性的“长期多代随访(long-term, multigenerational follow-up)”全面计划;
(8)在确保最大透明度和尊重病人隐私之间保持平衡;
(9)持续地重新评估健康益处和风险,以及社会益处和风险,包括利用公众提供的输入信息;
(10)建立可靠的监管以便防止出于阻止一种“严重疾病或症状”之外的原因使用这些技术。
3 未来如何发展?
当科学与伦理相遇时,我们就不能抛开科学谈伦理,更不能抛开伦理讲科学,我们时时刻刻都在享受的科学的飞速发展所带来的便利,但是当科学的发展超过的我们现有的伦理范畴,我们应该有必要减慢一下发展的速度,至少暂缓在实际中的应用。1975年阿西洛玛会议给我们做了一个很好的榜样,发现DNA重组技术可能存在潜在的生物危害,以伯格和罗伯特·波洛克为首的科学家呼吁自愿“暂停”重组DNA技术的相关研究,并号召全世界科学家和公众广泛参与科学政策的讨论。
我们现在又步入了一个新的十字路口,随着基因编辑技术的日渐成熟,基因治疗又重新进入了一个黄金时期,走在时代前沿的科学家们更应该保持清醒的头脑,站在人类社会发展的角度上,承担更多的社会责任,来应对新技术可能引起的伦理问题以及如何在科研群体中建立良性的自我约束和监督机制。只有这样才能再次避免基因治疗早期所遇到的惨痛教训,也只有这样基因治疗才能健康的发展。
参考文献
1.Friedmann, T。, A brief history of gene therapy。 Nat Genet, 1992。 2(2): p。 93-8。
2.Wade, N。, Gene therapy caught in more entanglements。 Science, 1981。 212(4490): p。 24-5。
3.Sheridan, C。, Gene therapy finds its niche。 Nat Biotechnol, 2011。 29(2): p。 121-8。
4.Blaese, R.M。, et al。, T lymphocyte-directed gene therapy for ADA- SCID: initial trial results after 4 years。 Science, 1995。 270(5235): p。 475-80。
5.Branca, M.A。, Gene therapy: cursed or inching towards credibility? Nat Biotechnol, 2005。 23(5): p。 519-21。
6.Cavazzana-Calvo, M。, et al。, Gene therapy of human severe combined immunodeficiency (SCID)-X1 disease。 Science, 2000。 288(5466): p。 669-72。
7.Gao, G.P。, et al。, Novel adeno-associated viruses from rhesus monkeys as vectors for human gene therapy。 Proc Natl Acad Sci U S A, 2002。 99(18): p。 11854-9。
8.Maguire, A.M。, et al。, Age-dependent effects of RPE65 gene therapy for Leber‘s congenital amaurosis: a phase 1 dose-escalation trial。 Lancet, 2009。 374(9701): p。 1597-605。
9.Nathwani, A.C。, et al。, Long-term safety and efficacy of factor IX gene therapy in hemophilia B。 N Engl J Med, 2014。 371(21): p。 1994-2004。
10.Nathwani, A.C。, et al。, Adenovirus-associated virus vector-mediated gene transfer in hemophilia B。 N Engl J Med, 2011。 365(25): p。 2357-65。
11.Maepa, M.B。, et al。, Progress and Prospects of Anti-HBV Gene Therapy Development。 International Journal of Molecular Sciences, 2015。 16(8): p。 17589-17610。
12.Engineering the Perfect Baby。 2015; Available from: https://www.technologyreview.com/s/535661/engineering-the-perfect-baby/。
13.Liang, P。, et al。, CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes。 Protein Cell, 2015。 6(5): p。 363-72。
14.Bosley, K.S。, et al。, CRISPR germline engineering-the community speaks。 Nat Biotechnol, 2015。 33(5): p。 478-86。
15.Human Genome Editing: Science, Ethics, and Governance。 2017
 中国经济发展令中国女性享受多彩多姿的生活。
中国经济发展令中国女性享受多彩多姿的生活。 中国经济急速发展,改变现代女性的生活面貌。
中国经济急速发展,改变现代女性的生活面貌。 对一些中国城市女性来说,找到合适对象并不是容易的事。
对一些中国城市女性来说,找到合适对象并不是容易的事。 一些老人担心未婚子女,在相亲角帮子女找对象。
一些老人担心未婚子女,在相亲角帮子女找对象。 不少中国人认为传宗接代非常重要。
不少中国人认为传宗接代非常重要。

 有人认为,中国未来会对未婚女性开放冻卵的权利。
有人认为,中国未来会对未婚女性开放冻卵的权利。








![图3 基因表达和传递的载体系统 [3]](http://n.sinaimg.cn/tech/crawl/20170627/Qa7L-fyhneam3570445.jpg)


![图六 基因编辑技术的发展 [11]](http://n.sinaimg.cn/tech/crawl/20170627/BvRL-fyhneam3570478.jpg)
